Gene therapy for cancer treatment
Un gène suicide efficace dans le traitement du cancer
Isabelle de Waziers - Ph. Beaune INSERM UMRS 1147
Notre but est de développer une nouvelle méthode de thérapie anti-cancéreuse consistant à sensibiliser des cellules tumorales à un anti-cancéreux par transfert d’un « gène suicide ». Cette approche vise à introduire, spécifiquement dans les tumeurs un gène suicide qui permet de transformer au sein même de la tumeur, un médicament, le cyclophosphamide, CPA (Endoxan®) en métabolites toxiques.
Nous avons construit un gène suicide capable de transformer très efficacement le CPA en métabolites toxiques (CYP2B6TM, un cytochrome P450 modifié par mutagenèse fusionné à la NADPH-cytochrome P450 réductase CYP2B6TM-RED). La séquence de ce « gène suicide optimisé » a fait l’objet d’un dépôt de brevet en 2012 PCT/EP2012/058219, et aux Etats-Unis en 2014 US-2014-012718A1.
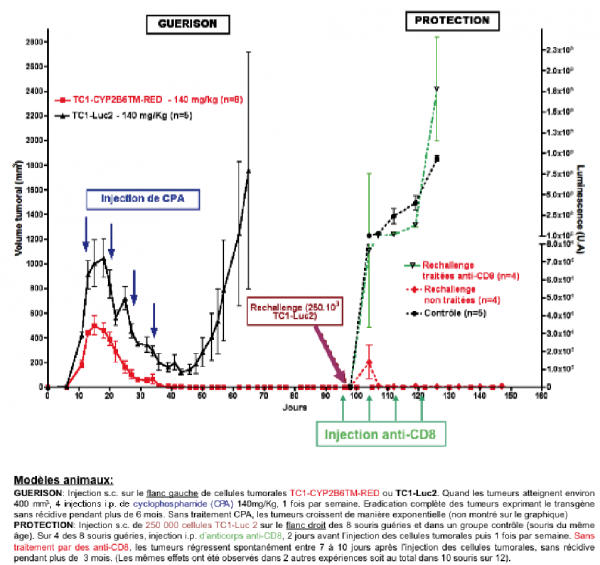
Nous avons, tout d’abord, montré in vitro que des cellules tumorales pulmonaires, devenaient sensibles au CPA quand on y introduisait notre gène-suicide. Nous avons montré sur des modèles de souris immuno-compétentes, qu’en exprimant notre gène suicide dans une tumeur, nous obtenions son éradication complète par le CPA sans aucune récidive plus de 24 mois après l’arrêt de tout traitement. Enfin nous avons démontré que le système immunitaire contribuait à l’efficacité de notre approche en participant à la destruction des cellules tumorales. Cette implication du système immunitaire est synergique avec la toxicité propre des métabolites du CPA puisqu’elle protège contre une récidive de la tumeur primaire, et pourrait également empêcher le développement de métastases secondaires.
Nous avons ainsi clairement montré que l’efficacité de notre approche était due à la combinaison d’une forte toxicité vis-à-vis des cellules tumorales, d’un effet by-stander et d’une réponse immune, combinaison qui n’a pas été mise en évidence dans d’autres approches par gène-suicide qui ont échouées.
Pour introduire notre gène suicide dans la tumeur nous avons testé, comme vecteur, les cellules souches mésenchymateuses (MSCs) qui migrent vers les tumeurs et s’y implantent. Elles sont facilement isolées à partir de moelle osseuse ou de tissu adipeux, sans poser de problèmes éthiques particuliers, elles peuvent se multiplier rapidement en culture, on peut y introduire facilement le gène suicide. Il paraît cependant plus efficace d’utiliser des lignées humaines commercialement disponibles, permettant après introduction de notre gène suicide et clonage de disposer d’un produit stable. Les MSCs contenant le gène suicide vont, au sein de la tumeur, transformer le CPA en produits toxiques qui peuvent facilement diffuser dans les cellules tumorales avoisinantes. Ainsi ces produits toxiques vont détruire les cellules tumorales mais également les MSCs qui les ont générés et empêcher ainsi tout risque de prolifération incontrôlée ou de dissémination de ces cellules.
Nous avons démontré, sur des modèles de tumeurs de souris, qu’après injection au sein de la tumeur de MSCs transduites celles-ci restaient nichées au niveau de la tumeur sans diffuser dans d’autres organes et que l’injection de CPA entraînait une éradication complète des tumeurs chez 30% des souris sans récidive plus de 6 mois après tout traitement. De plus la même réaction immunitaire est aussi observée chez les souris guéries.
Ces résultats encourageants pourraient néanmoins être améliorés en maîtrisant l’implantation des MSCs à proximité de la tumeur. En collaboration avec des radiologistes interventionnels (Pr. M Sapoval, Dr. O Pellerin, HEGP), nous avons testé l’efficacité de notre approche sur un modèle animal de lapins porteurs de tumeurs hépatiques (Vx2) en injectant les MSCs transduites par voie intra-artérielle au niveau de la tumeur. Deux injections de MSCs CYP2B6TM-RED/CPA permettent de faire régresser fortement les tumeurs et empêchent le developpement de métastases dans 2 / 3 lapins.
Nous avons également démontré, l’efficacité de ces MSCs contenant le gène suicide sur un grand nombre de cellules tumorales humaines (côlon, sein, ORL,…). Nous allons les utiliser pour cribler la sensibilité de nombreuses lignées tumorales humaines afin d’étendre le spectre des tumeurs sensibles à ce traitement.
La démonstration, sur deux modèles animaux et plusieurs types de tumeurs, de l’efficacité de notre stratégie est un atout crucial pour un futur développement clinique.